癌癥疫苗新突破:將癌細胞轉化為抗癌疫苗,既能清除癌細胞,還能防復發
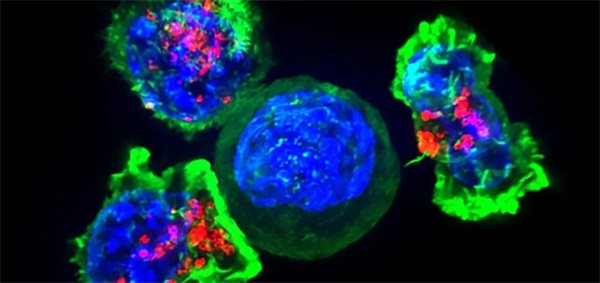
作者|王聰 來源|生物世界(ID:ibioworld)
治療性腫瘤細胞(ThTC)有望成為一類新的抗癌藥物,因為它們天然攜帶了腫瘤新抗原。這種方法已被證明可以觸發強大的免疫細胞轉運到腫瘤部位,從而在不同類型的癌癥中誘導抗腫瘤免疫反應。目前,已有幾項滅活腫瘤細胞治療包括非小細胞肺癌、結直腸癌、黑色素瘤等癌癥的臨床試驗。
然而,這種治療方法的臨床效益有限,甚至無效,這可能是由于這些治療性腫瘤細胞缺乏對腫瘤細胞的直接細胞毒作用,無法觸發強烈的抗腫瘤免疫反應。
與滅活腫瘤細胞不同,活的腫瘤細胞具有獨特的定位和靶向腫瘤的潛力。因此,通過工程化腫瘤細胞表達治療藥物是一種合理的方法,還可以利用其天然的新抗原來源。在各種用于癌癥治療的藥物中,干擾素β(IFN-β)因其同時具有直接作用(抑制腫瘤細胞增殖和血管生成)和間接作用(激活抗腫瘤免疫反應)而備受關注。但工程化腫瘤細胞穩定分泌IFN-β不僅會殺傷腫瘤細胞,也會自我殺傷。
2022年1月4日,哈佛大學醫學院的研究人員在Science 子刊 Science Translational Medicine 上發表了題為:Bifunctional cancer cell–based vaccine concomitantly drives direct tumor killing and antitumor immunity 的研究論文。
研究的開發了一種將癌細胞轉化為有效抗癌疫苗的新方法,可以消除已產生的腫瘤,并誘導長期免疫,訓練免疫系統使其防止癌癥復發。研究團隊在晚期致命腦腫瘤膠質母細胞瘤小鼠模型中驗證了這種雙功能抗癌疫苗的有希望的效果。

該論文的通訊作者Khalid Shah教授表示,團隊一直在追求一個簡單的想法:將癌細胞轉化為癌癥殺手和疫苗,現在,通過基因工程技術,團隊正在重新利用癌細胞來開發一種治療方法——殺死癌細胞,并刺激免疫系統,從而摧毀原發腫瘤并預防癌癥。
癌癥疫苗是當前的熱門研究方向,滅活腫瘤細胞可誘導有效的抗腫瘤免疫反應,然而,這種方法的有效性受到限制,因為它不能在誘導免疫反應之前殺死腫瘤細胞。與滅活腫瘤細胞不同,活的腫瘤細胞具有追蹤和靶向腫瘤的能力。
在這項研究中,Khalid Shah團隊采取的方法很獨特,他們沒有使用滅活腫瘤細胞,而是開發了一種基于活的腫瘤細胞的雙功能治療方法,具有直接殺傷腫瘤和免疫刺激作用。這些活的腫瘤細胞會在大腦中“長途跋涉”,回到同伴腫瘤細胞那里。
利用這種特性,研究團隊使用CRISPR-Cas9基因編輯技術改造活的腫瘤細胞,通過基因敲除干擾素-β(IFN-β)特異性受體,將這些腫瘤細胞從IFN-β敏感型轉化為耐受型,隨后改造它們以釋放免疫調節劑IFN-β和粒細胞-巨噬細胞集落刺激因子(GM-CSF)。GM-CSF的表達促進樹突狀細胞的抗原交叉呈遞、共刺激分子表達和促炎細胞因子產生的能力,從而為免疫系統的長期抗腫瘤反應做好準備。因此,這些基因工程改造的腫瘤細胞,既能殺傷腫瘤細胞,又能易于被免疫系統發現、標記和記憶,從而實現抗癌和防止復發的雙功能作用。
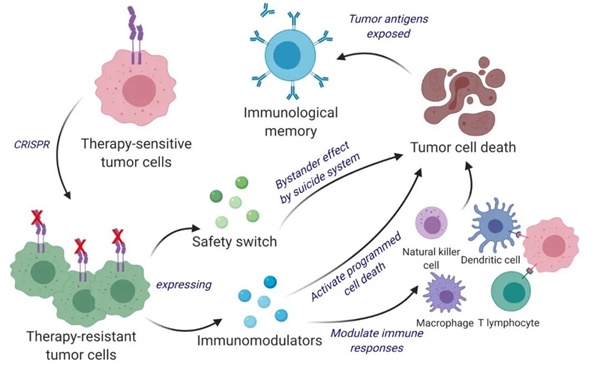
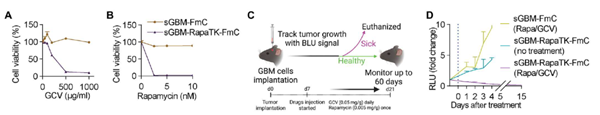
這些治療性腫瘤細胞(ThTC)通過誘導Caspase介導的癌細胞凋亡,下調癌癥相關成纖維細胞表達的血小板衍生生長因子受體β,激活抗腫瘤免疫細胞轉運和抗原特異性T細胞激活信號,消除小鼠中已建立的晚期膠質母細胞瘤腫瘤。
研究團隊還在多種原發性、復發性和轉移性小鼠癌癥模型,以及人源化小鼠模型(包括攜帶來自人類的骨髓、肝臟和胸腺細胞,模擬人類免疫微環境)中測試這種治療性腫瘤細胞(ThTC)的療效,結果顯示,ThTC能夠帶來生存益處并建立長期免疫。
由于這種癌癥疫苗使用的是活的腫瘤細胞,為了保證安全性,研究團隊在腫瘤細胞上加入了由1型單純皰疹病毒胸苷激酶(HSV-TK)和雷帕霉素激活的Caspase9組成的雙重安全開關,激活這一安全開關,就能根除這些治療性腫瘤細胞。
總的來說,該研究開發了一種基于獲得腫瘤細胞的雙功能抗癌疫苗,并在多種腫瘤小鼠模型驗證了安全性和有效性。這也表明了這種雙功能療法武裝天然富含新抗原的腫瘤細胞代表了一種有前途的實體腫瘤細胞免疫療法,為臨床轉化奠定了基礎和方向。
Khalid Shah教授表示,團隊目標是采取一種創新且可轉化的方法,以開發治療性抗癌疫苗,最終對醫學產生持久影響,這種治療策略適用于更廣泛的實體腫瘤,值得進一步探索。
論文鏈接:
https://www.science.org/doi/10.1126/scitranslmed.abo4778
編者按:本文轉載自微信公眾號:生物世界(ID:ibioworld),作者:王聰

前瞻經濟學人
專注于中國各行業市場分析、未來發展趨勢等。掃一掃立即關注。




























