一文帶你看中國生物類似藥市場發展現狀 國內進入發展黃金期
生物類似藥,也被稱為生物仿制藥,是指在質量、安全性和有效性方面與已獲準注冊的參照藥具有相似性的治療用生物制品。隨著原研生物藥專利到期及生物技術的不斷發展,以原研生物藥質量、安全性和有效性為基礎的生物類似藥的研發,有助于提高生物藥的可及性和降低價格,滿足群眾用藥需求。
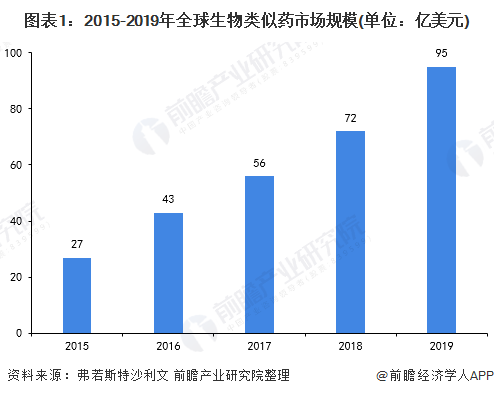
全球市場規模95億美元
2006年,歐盟在全球率先提出“生物類似藥”的概念及相關技術要求,在此基礎上,WHO、韓國、日本和美國也相繼發布了生物類似藥的相關技術要求。2013年,歐盟第一個單克隆抗體生物類似藥獲批;2015年,美國首款生物類似藥獲批。自第一個生物類似藥獲批以來,全球生物類似藥市場逐年增長,2019年約為95億美元,增長幅度超過30%。
中國生物類似藥市場開始“起飛”
我國生物類似藥起步較晚,由于生物藥的研發和生產壁壘較高,在2019年之前中國尚未有國產生物類藥獲批上市。2015年2月,中國藥品監管部門制訂發布了《生物類似藥研發與評價技術指導原則(試行)》。這為研發企業提供了方向,一部分中國醫藥研發企業快速布局生物類似藥開發。
2019年2月25日,NMPA批準了復宏漢霖的利妥昔單抗注射液(商品名:漢利康®)的上市,該藥是復宏漢霖旗下自主研發的首個單抗藥物,也是首個中國“國產”生物類似藥。也因此,2019年被稱為中國生物類似藥的元年。隨后,我國國產生物類似藥陸續獲批,2019年共獲批4款。截至2020年9月2日,國內生物類似藥共有8個獲批上市,我國生物類似藥迎來了突破性的進展。

從市場規模來看,我國生物類似藥市場規模在不斷擴大,2019年更是有了大幅度的增長。2019年2月,復宏漢霖的利妥昔單抗注射液獲批上市,2019年全年,其銷售額達到7900萬元;2020年上半年,復宏漢霖的利妥昔單抗注射液的銷售額更是達到9580萬元,增長迅速。同時,2019年我國生物類似藥的市場規模接近30億元,增長幅度較大。

中國生物類似藥研發管線數量領跑全球
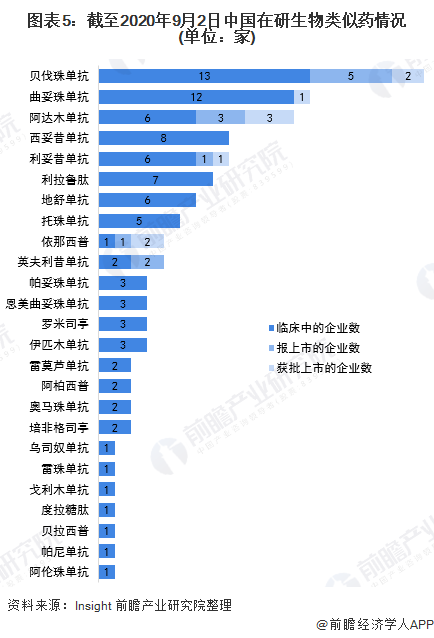
與國際相比,我國生物類似藥的研發起步較晚,因此,技術要求和研發能力的高起點成為我國生物類似藥發展的一大特點。目前中國已成為生物類似藥在研藥物數量最多的國家,大陸地區擁有391條生物類似藥研發管線,高于印度和美國。

從藥物研發類型來看,我國在研生物類似藥大多集中在利妥昔單抗、曲妥珠單抗、貝伐珠單抗、阿達木單抗等幾款全球暢銷藥品上。其中,熱門品種中在研企業數超過10家的有三款,分別是貝伐珠單抗、曲妥珠單抗和阿達木單抗,目前三個爆款藥物國內均有生物類似藥獲批。
政策鼓勵生物類似藥發展
近年來,我國不斷制定和頒布多項鼓勵生物類似藥研發的相關政策,促進中國生物類似藥市場的發展。2015年3月,國家藥品監督管理局(NMPA)發布了《生物類似藥研發與評價技術指導原則(試行)》,首次明確了生物類似藥的定義,提出了生物類似藥研發和評價的基本原則,對生物類似藥的藥學、非臨床和臨床研究和評價等內容提出了具體的要求。為進一步規范此類藥物的研發,提高其安全性、有效性和質量控制水平奠定了良好基礎。
2016年7月,《注冊管理辦法(修訂稿)》進一步規范了生物類似藥的概念,嚴格了生物類似藥的審批標準。
2017年7月,CDE發布關于“貝伐珠單抗注射液生物類似藥臨床研究設計及審評的考慮”征求意見通知,這是首次基于單品種研發制定審評要點。
這些政策的陸續出臺,為生物類似藥的發展提供了有利的條件,對于我國生物類似藥的開發具有極其重要的指導意義。未來,我國生物類似藥發展潛力巨大,預計接下來幾年將迎來發展黃金期。

以上數據來源于前瞻產業研究院《中國生物制藥行業技術研發與新品上市分析報告》,同時前瞻產業研究院提供產業大數據、產業規劃、產業申報、產業園區規劃、產業招商引資等解決方案。
更多深度行業分析盡在【前瞻經濟學人APP】,還可以與500+經濟學家/資深行業研究員交流互動。
前瞻產業研究院 - 深度報告 REPORTS
報告主要分析了中國生物制藥行業關鍵技術、前沿技術及相關生命科學技術的發展現狀與趨勢,行業主要產品研發進展,從不同規模、類型企業分析了行業產品專利技術,主要生物...
如在招股說明書、公司年度報告中引用本篇文章數據,請聯系前瞻產業研究院,聯系電話:400-068-7188。

前瞻經濟學人
專注于中國各行業市場分析、未來發展趨勢等。掃一掃立即關注。





























