從2018年恒瑞醫藥年報看中國醫藥發展現狀-研發與仿制雙輪驅動下的恒瑞醫藥
恒瑞的創新模式從創新初期“me-too”、“me-better”逐步走向源頭創新,創新藥布局正在從小分子藥物向大分子藥物轉變,產生了具有自主知識產權的抗體毒素融合物(ADC)技術平臺,掌握了腫瘤免疫抗體系列產品開發專有技術。此外,公司還搭建了一系列研發平臺,并率先在國內申請國際領先的抗體毒素偶聯物 ADC 藥物(生物導彈)。恒瑞醫藥表示,2018年公司有56個創新藥正在臨床開發,“在創新藥開發上,已基本形成了每年都有創新藥申請臨床,每2-3年都有創新藥上市的良性發展態勢。”
重磅藥分布均衡
恒瑞醫藥是國內最大的抗腫瘤藥、手術用藥和造影劑的研究和生產基地之一。公司產品涵蓋了抗腫瘤藥、手術麻醉類用藥、特色輸液、造影劑、心血管藥等眾多領域,已形成比較完善的產品布局,其中抗腫瘤、手術麻醉、造影劑等領域市場份額在行業內名列前茅。報告期內,恒瑞醫藥獲得由中國化學制藥工業協頒發的“2018 中國化學制藥行業工業企業綜合實力百強”、“2018 中國化學制藥行業創新型優秀企業品牌” 等眾多榮譽。
“研發一哥”恒瑞醫藥發布2018年業績,公司營業收入超174億元,同比增長25.89%;歸屬于上市公司股東的凈利潤首破40億元,同比增長26.39%。恒瑞醫藥至2000年上市以來,業績一路飆漲,2018年各項經濟指標穩步增長。

公司主營業務涉及藥品研發、生產和銷售,主要產品涵蓋抗腫瘤藥、手術麻醉類用藥、特殊輸液、造影劑、心血管藥等眾多領域。根據營業執照,公司主營業務是片劑(含抗腫瘤藥)、口服溶液劑、混懸劑、原料藥、精神藥品、軟膠囊劑(含抗腫瘤藥)、凍干粉針劑(含抗腫瘤藥)、粉針劑(抗腫瘤藥、頭孢菌素類)、吸入粉霧劑、口服混懸劑、口服乳劑、大容量注射劑(含多層共擠輸液袋、含抗腫瘤藥)、小容量注射劑(含抗腫瘤藥、含非最終滅菌),生物工程制品(聚乙二醇重組人粒細胞刺激因子注射液)、硬膠囊劑(含抗腫瘤藥)、顆粒劑(抗腫瘤藥)、粉霧劑、膜劑、凝膠劑、乳膏劑的制造;中藥前處理及提取;醫療器械的研發、制造與銷售;一般化工產品的銷售;自營和代理各類商品及技術的進出口業務,但國家限定公司經營或禁止進出口的商品和技術除外。

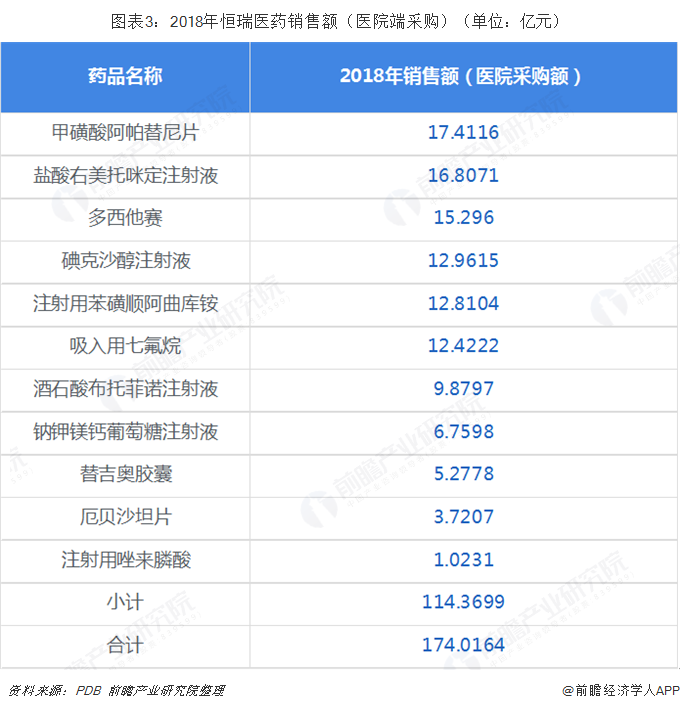
恒瑞醫藥在2018年170多億的銷售額中前十藥品立下了汗馬功勞。從適用癥的角度來看,基本都是來自于腫瘤、麻醉和造影,而且這幾個行業的空間還非常大,另外在腫瘤領域,目前恒瑞醫藥的馬來酸吡咯替尼片已經在2018年上市,卡瑞珠單抗獲得優先審評,預計可以為后續提供足夠的潛力。同時2018年鹽酸右美托咪定注射液也是做到了接近17億的銷售額。相比之下,國內其他藥企巨頭產品結構可能就不如恒瑞,石藥恩必普一品獨大,揚子江的地佐新規模突顯,齊魯神經節苷脂已經在走下坡路,正大天晴已經把恩替卡韋也是一樣。
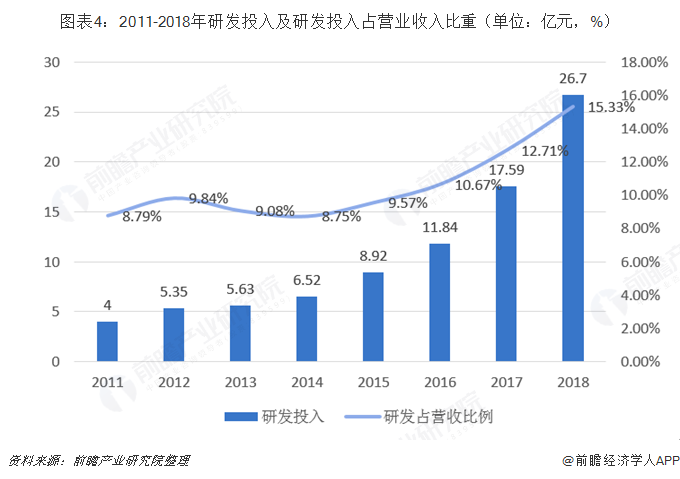
研發投入大幅增長
恒瑞2018年年報最亮眼的地方就在于研發費用的繼續飆升,恒瑞2018年累計投入研發資金26.70億元(+51.81%),增幅高于2017年的+48.53%,在已公布年報的制藥公司中遙遙領先,為項目研發和創新發展提供了有力支持。
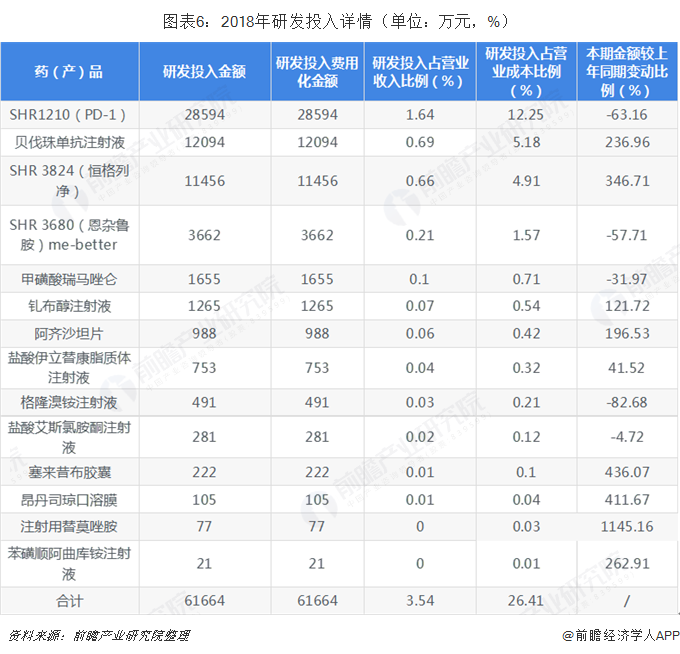
而專利申請和維持工作也是順利開展。2018年度提交國內新申請專利144件,提交國際PCT新申請78件,獲得國內授權26件,獲得國外授權39件。五是項目注冊申報有序推進。

截止年報公布,恒瑞已有4個創新藥艾瑞昔布、阿帕替尼、硫培非格司亭注射液和吡咯替尼獲批上市,一批創新藥正在臨床開發,并有多個創新藥在美國開展臨床。財報顯示:恒瑞2018年度取得創新藥制劑生產批件2個,取得創新藥臨床批件16個。硫培非格司亭注射液成功獲批上市,吡咯替尼臨床II期取得突破性療效,獲得有條件批準上市,卡瑞利珠單抗(淋巴瘤適應癥)獲得優先審評資格且已完成技術審評工作。
2018年PD-(L)1熱卷全國,百時美施貴寶的納武利尤單抗注射液以及默沙東PD-1單抗帕博利珠單抗注射液分別于6月、7月相繼獲批,隨后12月,國內企業君實生物的特瑞普利單抗注射液以及信達生物的信迪利單抗注射液獲批后,市場形成了2進口+2國產的競爭局面。恒瑞醫藥年報中提到,目前卡瑞利珠單抗(淋巴瘤適應癥)獲得優先審評資格且已完成技術審評工作。此外,百濟神州的替雷利珠單抗注射液也被納入了優先審評,目前也正在審評審批中。預測接下來市場將進入價格爭奪戰。

仿制藥一致性評價
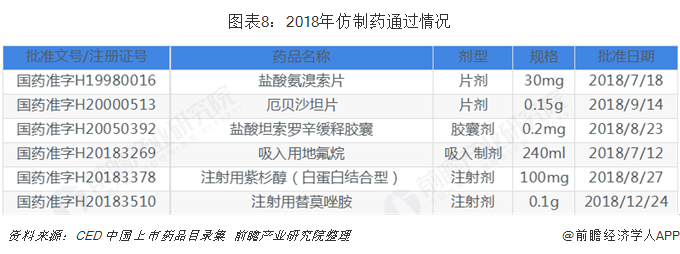
除了創新藥項目投入,恒瑞積極推動仿制藥質量和療效一致性評價工作。財報顯示:恒瑞2018報告期內取得3個一致性評價批件,遞交18種產品參比制劑備案材料,完成10種產品的BE工作,完成15種產品的一致性評價申報工作。
仿制藥國際化
財報顯示:恒瑞2018年繼續加大了國際化戰略的實施力度,積極拓展海外市場,實現海外銷售收入6.51億元人民幣。
仿制藥國際化方面,地氟烷、注射用塞替派、磺達肝癸鈉注射液等在美國獲批,碘克沙醇注射液在英國和荷蘭獲批,鹽酸右美托咪定注射液在日本獲批。恒瑞2018年分別向美國FDA遞交了2個注射劑、1個原料藥,向日本遞交1個原料藥的注冊申請;其他新興市場如澳大利亞、南非、中東 地區等國家也逐步加強注冊力度。
創新藥國際化方面,SHR0302片、INS068注射液、 SHR0410注射液3個產品獲準在海外開展臨床試驗。

優先審評碩果累累
自2015年12月底推行優先審評政策以來,國內多家創新型藥企受惠加速了新品上市速度。恒瑞醫藥(含子公司)共有29個受理號被成功納入優先審評,截至目前已有9個產品(10個受理號)獲批生產,一個產品獲批臨床。
2018年被成功納入優先審評的10個受理號中,有7個受理號(涉及1個原料藥,5個注射劑,1個膠囊劑)正在審評審批中,兩個1類新藥注射用甲苯磺酸瑞馬唑侖以及注射用卡瑞利珠單抗備受業界期待。
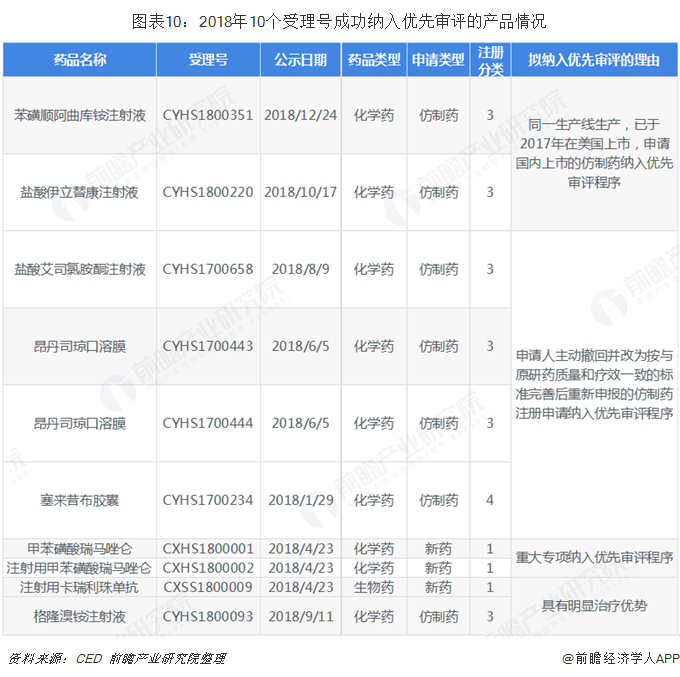
注射用甲苯磺酸瑞馬唑侖是一種短效的GABAa受體激動劑,適用于擇期手術中的全身麻醉。據米內網數據顯示,2017年中國公立醫療機構終端全身麻醉劑TOP20廠家排名中,恒瑞醫藥以17.9億元排在第二位。2018年,恒瑞醫藥的麻醉線產品同比增長29.25%,繼續保持穩定增長態勢,若注射用甲苯磺酸瑞馬唑侖成功獲批,將大大增強公司在全身麻醉劑市場的競爭力。
以上數據來源參考前瞻產業研究院發布的《中國醫藥行業市場前瞻與投資戰略規劃分析報告》
更多深度行業分析盡在【前瞻經濟學人APP】,還可以與500+經濟學家/資深行業研究員交流互動。
前瞻產業研究院 - 深度報告 REPORTS
本報告前瞻性、適時性地對醫藥行業的發展背景、供需情況、市場規模、競爭格局等行業現狀進行分析,并結合多年來醫藥行業發展軌跡及實踐經驗,對醫藥行業未來的發展前景做...
如在招股說明書、公司年度報告中引用本篇文章數據,請聯系前瞻產業研究院,聯系電話:400-068-7188。

前瞻經濟學人
專注于中國各行業市場分析、未來發展趨勢等。掃一掃立即關注。





























