MNC豪賭炎癥性腸病:未被滿足需求,即是商業(yè)爆點
作者|青櫟 來源|醫(yī)曜
在許多人的認(rèn)知中,胃腸不適只是一件小事,吃點藥、休息休息便會好轉(zhuǎn)。但對于重度克羅恩病患者而言,這卻是一場持續(xù)不斷、難以擺脫的噩夢:他們常常被劇烈的腹痛折磨,腸道功能嚴(yán)重受損,甚至連正常吃飯都成了奢望,每一次進食都可能引發(fā)難以忍受的疼痛和腹瀉,身體逐漸消瘦,生活質(zhì)量急劇下降。
這種被稱為“綠色癌癥”的炎癥性腸病(IBD),正以每年3%-5%的增速在全球蔓延,中國患者數(shù)量從2017年的44.9萬激增至2030年預(yù)計的120萬。這一數(shù)字背后,不僅是無數(shù)患者身心層面遭受的巨大煎熬,更是一個充滿機遇與挑戰(zhàn)的百億美元級藥物戰(zhàn)場。
01
IBD的“真面目”
炎癥性腸病(IBD)并非單一的疾病,而是一類慢性非特異性腸道炎癥性疾病,主要包括潰瘍性結(jié)腸炎(UC)和克羅恩病(CD),常見癥狀為嚴(yán)重腹痛、腹瀉、營養(yǎng)不良等。
盡管臨床表現(xiàn)十分明確,但BD確切的病因至今尚未明確,目前普遍認(rèn)為它是由多種因素引起的,受到環(huán)境、遺傳、感染和免疫因素之間的相互影響,其中免疫因素被認(rèn)為是導(dǎo)致IBD的重要因素之一。
普通人的健康狀態(tài)下,腸道需 “雙重調(diào)節(jié)”:一方面,要對食物抗原以及共生菌群保持耐受,維持腸道微生態(tài)穩(wěn)定;另一方面,需有效抵御病原體入侵,保障腸道健康。然而,IBD患者體內(nèi)這一精妙平衡被打破。腸道黏膜免疫系統(tǒng)對腸道菌群產(chǎn)生異常的免疫激活,導(dǎo)致促炎細(xì)胞因子(如TNF-α、IL-1β和IL-6等)大量釋放,這些細(xì)胞因子進一步招募和激活更多的免疫細(xì)胞,引發(fā)級聯(lián)反應(yīng),致使炎癥瀑布效應(yīng)不斷加劇。
在免疫細(xì)胞層面,多種細(xì)胞參與了IBD的發(fā)病過程。例如,Th1細(xì)胞和Th17細(xì)胞過度活化,持續(xù)分泌大量炎癥介質(zhì),極大地推動了炎癥反應(yīng)的進展。而調(diào)節(jié)性T細(xì)胞數(shù)量的減少或功能的缺陷,使其無法有效抑制過度的免疫反應(yīng),進而造成免疫失衡。此外,巨噬細(xì)胞、樹突狀細(xì)胞等固有免疫細(xì)胞對腸道菌群的識別和處理出現(xiàn)異常,啟動并維持了腸道內(nèi)的慢性炎癥狀態(tài)。
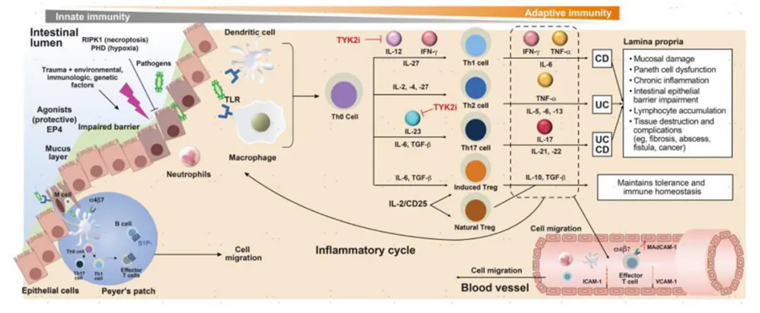
圖:IBD的免疫學(xué)發(fā)病機制,來源:中金公司
在遺傳因素方面,研究表明IBD具有一定的家族聚集性,某些特定基因變異與IBD發(fā)病風(fēng)險增加密切相關(guān)。這些基因廣泛參與免疫調(diào)節(jié)、腸道屏障功能維持等關(guān)鍵生理過程。與此同時,環(huán)境因素也起到推波助瀾的作用,比如飲食結(jié)構(gòu)的改變,過度攝入高脂肪、高糖食物,以及長期處于精神壓力大的狀態(tài),都可能誘發(fā)或加重IBD。
相關(guān)流行病學(xué)數(shù)據(jù)表明,當(dāng)前全球范圍內(nèi)約有600-800萬IBD患者。其中,歐洲的IBD患者數(shù)量已超300萬,美國的患者數(shù)量超過200萬。在過去,IBD被視為歐美地區(qū)的高發(fā)疾病,甚至被認(rèn)為是西方國家特有的病癥。但近十年來,亞洲地區(qū)IBD的發(fā)病率急劇上升。以國內(nèi)為例,潰瘍性結(jié)腸炎的患病率達到了11.6/10 萬,克羅恩病的患病率為2.29/10萬,并且患者年輕化趨勢顯著,發(fā)病年齡集中在15-30歲。到2025年,中國的IBD患者數(shù)量預(yù)計將突破150萬人。
龐大的患者基數(shù)構(gòu)成了強勁的藥物需求,當(dāng)前IBD全球市場約為180億美元,但患者仍存在著巨大的臨床未滿足需求,對有效的治療藥物有著迫切的需求。隨著發(fā)病率的快速增長,到2030年IBD市場規(guī)模將達到490億美元,一款安全有效IBD新藥的面世,就意味著一款重磅炸彈的誕生。
02
50億美元爆款
自20世紀(jì)20年代克羅恩醫(yī)生發(fā)現(xiàn)克羅恩病以來,人類便持續(xù)與IBD進行著艱苦對抗。
早期的時候,因為缺乏有效的藥物,腸切除手術(shù)成為緩解IBD癥狀的主要手段。然而,術(shù)后復(fù)發(fā)率居高不下,患者生活質(zhì)量受到嚴(yán)重影響。直到1938年磺胺類藥物問世,IBD 治療范式才首次轉(zhuǎn)向藥物。
第一代IBD藥物,主要包括氨基水楊酸制劑、糖皮質(zhì)激素和免疫抑制劑等傳統(tǒng)藥物。
氨基水楊酸制劑如柳氮磺吡啶,通過在腸道內(nèi)分解產(chǎn)生5-氨基水楊酸,抑制炎癥介質(zhì)的產(chǎn)生,減輕腸道炎癥;糖皮質(zhì)激素具有強大的抗炎作用,能迅速減輕腸道黏膜的炎癥反應(yīng),對于急性發(fā)作期的患者,激素可以快速控制病情,有效緩解患者的腹痛、腹瀉和便血等癥狀,為后續(xù)治療爭取時間;傳統(tǒng)免疫抑制劑如硫嘌呤、甲氨蝶呤等,通過抑制免疫系統(tǒng)中淋巴細(xì)胞的增殖和活性,調(diào)節(jié)機體免疫反應(yīng),從而減輕腸道炎癥。
盡管第一代IBD藥物滿足了當(dāng)時最迫切的臨床需求,但仍存在明顯的局限性。如氨基水楊酸制劑對于病情較重的患者療效欠佳;長期使用糖皮質(zhì)激素會引發(fā)骨質(zhì)疏松、血糖升高、血壓上升、感染風(fēng)險增加等一系列不良反應(yīng);傳統(tǒng)免疫抑制劑則可能導(dǎo)致骨髓抑制、肝腎功能損害、胃腸道不適、感染風(fēng)險加劇等問題。
伴隨醫(yī)學(xué)研究的不斷深入,第二代藥物應(yīng)運而生。1998年美國FDA批準(zhǔn)英夫利西單抗用于CD的治療,標(biāo)志著IBD的治療進入生物制劑時代。隨后阿達木單抗、戈利木單抗等陸續(xù)上市,這些抗TNF-α制劑能特異性地與TNF-α結(jié)合,阻斷其炎癥作用,讓治療效果上了一個臺階。
2014年,α4β7整合素抑制劑維得利珠單抗(Entyvio)上市,通過阻斷淋巴細(xì)胞歸巢至腸道,降低全身免疫抑制風(fēng)險,成為UC和CD治療新的里程碑。相較于其他生物制劑,Entyvio具有腸道高選擇性,對促進腸道黏膜修復(fù)效果較好,無明顯全身性免疫抑制作用,治療過程中感染及腫瘤風(fēng)險較低,且終身治療成本較低。2022年,Entyvio銷售額首次突破50億美元,2024年延續(xù)增長勢頭達到58.41億美元,同比增長9.60%。
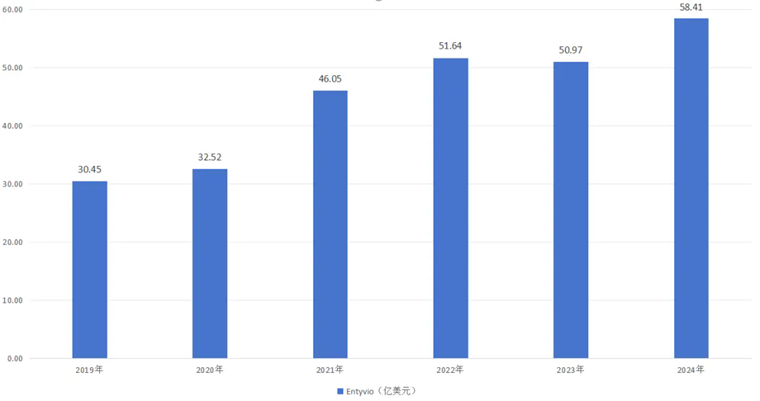
圖:維得利珠單抗?fàn)I收一覽,來源:錦緞研究院
此外,針對不同靶點的小分子藥物也開始在IBD治療領(lǐng)域嶄露頭角。JAK抑制劑(如托法替布、烏帕替尼),可選擇性抑制JAK激酶,阻斷JAK-STAT通路,更精準(zhǔn)地調(diào)節(jié)免疫和炎癥反應(yīng),對特定細(xì)胞因子介導(dǎo)的炎癥有良好的抑制作用。小分子藥物因口服便捷,極大提高了用藥的依從性,2024年Rinvoq(烏帕替尼)銷售額達到59.71億美元(多適應(yīng)癥),同比增長50.4%,小分子藥物潛力鋒芒畢露。
新一代IBD治療藥物,尤其是Entyvio的成功,不僅為眾多IBD患者帶來了新的希望,也讓醫(yī)藥行業(yè)看到了IBD治療領(lǐng)域的巨大潛力。盡管IBD在自身免疫疾病領(lǐng)域?qū)儆谛∵m應(yīng)癥,患者群體相對某些常見疾病不算龐大,但Entyvio的成功證明了,即使是小眾適應(yīng)癥,只要能精準(zhǔn)滿足患者需求,研發(fā)出真正有效的藥物,依然能夠在市場上取得巨大成功,這也吸引了眾多藥企紛紛將目光投向IBD賽道,探尋更多的市場機會。
03
巨頭的戰(zhàn)場
盡管IBD治療領(lǐng)域已經(jīng)有了諸多藥物布局,從早期的激素、免疫抑制劑,到如今的明星藥物Entyvio,但IBD治療仍存在巨大未滿足需求。在生物制劑治療方面,約30%的IBD患者出現(xiàn)原發(fā)無應(yīng)答,并且IBD復(fù)發(fā)率極高,80%的患者會慢性復(fù)發(fā),20%~30%的患者在多次復(fù)發(fā)后不得不進行手術(shù)治療,切除部分腸道,嚴(yán)重影響患者的生活質(zhì)量。
面對龐大的市場需求,MNC紛紛加大在IBD領(lǐng)域的投入,積極尋找更有效的治療方案。目前,有兩個核心方向備受關(guān)注。第一個核心方向是TL1A靶點,另一個是成功靶點α4β7的小分子化。
具體來看,TL1A與TNF-α同屬TNF超家族,在炎癥反應(yīng)中發(fā)揮著舉足輕重的作用。它不僅能夠激活免疫系統(tǒng),促使炎癥因子大量釋放,還能刺激TH1和TH17途徑,而這些途徑與腸道炎癥及纖維化的部位和嚴(yán)重程度密切相關(guān)。此外,TL1A可激活成纖維細(xì)胞,這類細(xì)胞正是纖維化的主要來源。
TL1A因其在炎癥與纖維化中的雙重作用成為各大MNC眼中IBD領(lǐng)域的“必爭之地”。
2023年10月,羅氏斥資72.5億美元收購輝瑞與Roivant的子公司Telavant,從而獲取TL1A抗體RVT-3101的全球權(quán)益,目前該藥已進入III期臨床階段;默沙東則以108億美元收購Prometheus Biosciences,獲得其TL1A抗體PRA023,其研發(fā)進度與RVT-3101相近;賽諾菲與Teva達成合作協(xié)議,共同開發(fā)TL1A單抗TEV-48574;在TNF-α靶點收獲頗豐的艾伯維也拿下明濟生物一款處于臨床前階段的TL1A抗體 FG-M701。
幾乎所有的巨頭都在重磅布局,這樣的預(yù)期促使TL1A 靶點有望成為繼TNF-α、IL-23之后,IBD領(lǐng)域的又一個“爆款靶點”。
另一個備受關(guān)注的方向是α4β7小分子。Entyvio的成功,充分驗證了α4β7 靶點在IBD治療中的價值。然而,作為大分子單克隆抗體,Entyvio存在需注射給藥、生產(chǎn)成本高等局限性。小分子藥物具有口服便捷、生產(chǎn)成本相對較低等優(yōu)勢,若能成功研發(fā)出有效的α4β7小分子藥物,將顯著改善患者的用藥體驗,提升治療的可及性。
目前,多家藥企正在研發(fā)口服小分子α4β7抑制劑,期望復(fù)制甚至超越Entyvio的成功。2024年7月,禮來與Morphic Therapeutics達成收購協(xié)議,交易總金額高達32億美元,而Morphic的核心管線就是處于II期臨床階段的小分子整合素α4β7抑制劑MORF-057。就在禮來收購 Morphic 的一個月前,由Telavant公司核心團隊創(chuàng)立的Ensho Therapeutics宣布從衛(wèi)材引進小分子α4β7抑制劑NSHO-101/EA1080,該產(chǎn)品或?qū)⑴c禮來的 MORF-057開啟研發(fā)競速賽。
除此以外,S1P受體調(diào)節(jié)劑、IL-23抑制劑、JAK/TYK2抑制劑等靶點也是IBD治療領(lǐng)域值得關(guān)注的潛力靶點。同時,當(dāng)前IBD治療靶點已不再局限于單一的抗炎路徑,而是朝著多機制聯(lián)合的方向發(fā)展,融合炎癥抑制、黏膜修復(fù)以及菌群調(diào)節(jié)等多種機制。展望未來,長效制劑的研發(fā)與聯(lián)合療法的探索,極有可能成為IBD治療取得重點突破的關(guān)鍵方向 。
Entyvio的50億美元銷售神話或許只是一個引子,它引領(lǐng)了MNC在IBD領(lǐng)域的投資熱潮。IBD領(lǐng)域持續(xù)演繹著“未被滿足的臨床需求,即是商業(yè)爆發(fā)點”的定律。對藥企而言,誰能率先取得突破,誰就能在千億自免市場中占據(jù)制高點;對患者而言,更多創(chuàng)新療法的涌現(xiàn),終將讓“自由進食”不再是遙不可及的奢望。
編者按:本文轉(zhuǎn)載自微信公眾號:醫(yī)曜,作者:青櫟

前瞻經(jīng)濟學(xué)人
專注于中國各行業(yè)市場分析、未來發(fā)展趨勢等。掃一掃立即關(guān)注。




























