張鋒最新Nature論文:借助AlphaFold,改造出全新蛋白質定向遞送系統
作者|生物世界 來源|生物世界(ID:ibioworld)
如果把細胞比作是精密的機械鐘表,那么蛋白質就是其內部大大小小的齒輪,它們是生命活動的主要執行者,發揮著生命基石般的關鍵作用。而蛋白質結構是其功能的基礎,如果我們能任意改造蛋白質結構,那么就能自由控制其功能,其潛在應用無疑非常巨大。
要想實現這一點,準確預測或解析蛋白質的三維空間構象是關鍵第一步。在過去,想要確定蛋白質結構不僅困難而且耗時耗力。而隨著人工智能(AI)技術的發展,DeepMind公司開發的AlphaFold,能夠僅依據蛋白質序列信息,就能快速準確預測蛋白質三維結構,其強大的能力受到越來越多的關注和應用。
2023年3月29日,CRISPR基因編輯先驅張鋒教授及其團隊在 Natrue 期刊發表了題為:Programmable protein delivery with a bacterial contractile injection system 的研究論文。
在這項最新研究中,張鋒團隊通過AlphaFold輔助蛋白質設計開發了一種蛋白質遞送系統——改造、利用獨特的細菌“注射器”將蛋白質注射到人類細胞中。這種新型蛋白質遞送方式或將改變基因治療、癌癥治療等前沿療法格局,具有強大的應用前景。

內共生細菌是一類特殊的細菌,它們可以寄生在宿主細胞的內部,并已然進化出復雜的傳遞系統使其分泌調節宿主細胞的生物因子。例如,細胞外可收縮注射系統(eCIS),正是這樣一種類似于“注射器”的大分子復合物。eCIS通過驅動一個“針頭”結構穿透細胞膜,然后將攜帶的蛋白質有效載荷注入到真核細胞中。
eCIS廣泛分布在細菌和古菌中,并已被證明具有多種天然功能,包括調節宿主細胞骨架、DNA切割,誘導變形運動和產生宿主毒性。最近,有研究發現eCIS可以靶向小鼠細胞,這就提高了eCIS作為蛋白質遞送工具的可能性。
然而,eCIS的活性尚未在人類細胞中得到證實,如果想要將eCIS開發為靶向遞送系統,就要先闡明eCIS識別靶細胞的機制。
在這項最新研究中,張鋒團隊首先選定了eCIS的一個亞型——Photorhabdus virulence cassette(PVC)。PVC由一個約20kb的操縱子組成,包含16個核心基因(pvc1-16),以及下游的有效載荷Pdp1和Pnf。研究團隊發現,PVC有效載荷蛋白的N端高度無序區域是其“包裝結構域”,只要將其與想要遞送的蛋白(例如GFP)融合,就能將其加載到PVC復合體中。

PVC系統可以被重新編程以在真核細胞中定制蛋白遞送
值得注意的是,除了N端高度無序區域之外,Pvc13(尾纖維蛋白)和Pvc15(一種ATP酶)也是該遞送系統成功的關鍵。其中,Pvc13可能參與了PVC復合體的靶標識別,并可用于操縱PVC復合體的靶標特異性。
基于此,研究團隊使用AlphaFold預測Pvc13的三維結構,當將其作為三聚體時,Pvc13的C端形成了一個預測的螺旋管結構和一個球狀的尖端結合結構域。研究團隊由此假設,改變Pvc13的這個尖端結合域的結構特征可能會導致PVC的靶向性發生可預測的變化。
AlphaFold預測和改造Pvc13,以改變PVC系統的宿主細胞靶向性
為了驗證這一點,研究團隊將針對人類細胞的結合結構域(Ad5-knob和E01-DARPin)插入到Pvc13的C端結合域,并測試由此產生的PVC復合體是否可以靶向人類細胞。結果顯示,改造后的PVC可以有效殺死A549細胞(攜帶毒性基因)或高效表達GFP(融合蛋白)。
這些結果表明,Pvc13是PVC復合體的一個靶向性決定元件,該蛋白可以被修飾,從而靶向特定的細胞系。
PVC介導的蛋白遞送具有高度特異性
進一步研究顯示,改造后的PVC復合體還可以自由裝載spCas9、鋅指脫氨酶(ZFD)以及細胞毒素等不同的效應元件,前兩者分別實現對靶細胞DNA的基因編輯和不依賴RNA的基因編輯,后者則可以靶向清除癌細胞、衰老細胞等有害細胞。
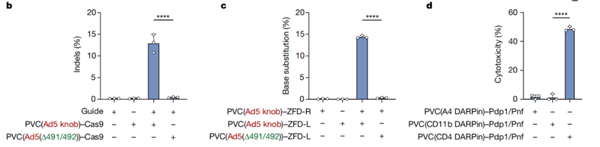
改造后的PVC系統可以靶向遞送多種效應元件
不僅如此,為了驗證PVC遞送系統在活體動物中的效果,張鋒團隊再次使用AlphaFold引導Pvc13的工程化設計,并篩選到兩種靶向小鼠細胞的PVC系統——Pcc-13-Ad5-knob(RGD/PK7)和Pvc13-Anti-MHCII Nb。與預期一致,前者表現出較為廣泛的趨向性(正如Ad5 RGD/PK7病毒感染那樣),而后者則對MHC+免疫細胞表現出強烈的偏好性。
張鋒團隊還發現,PVC治療沒有產生任何顯著的免疫細胞激活、炎癥細胞因子產生、體重損失或細胞毒性,這表明PVC治療在實驗過程中沒有產生免疫原性或毒性。此外,PVC治療七天后就無法從小鼠大腦中檢測到PVC相關蛋白,這表明PVC遞送系統僅在大腦中短暫停留,不會持續太長時間。

重編程的PVC系統在小鼠體內實現靶向遞送
總的來說,這些結果表明,PVC系統經過改造后可以在細胞和體內靶向遞送蛋白質,并在基因編輯、癌癥治療和臨床靶向遞送等領域展現出廣闊的應用前景,未來可能成為許多生物療法的關鍵遞送工具。
論文鏈接:
https://www.nature.com/articles/s41586-023-05870-7
編者按:本文轉載自微信公眾號:生物世界(ID:ibioworld),作者:生物世界

前瞻經濟學人
專注于中國各行業市場分析、未來發展趨勢等。掃一掃立即關注。




























