預見2023:《2023年全球“新冠特效藥”行業全景圖譜》(附市場現狀、發展格局和發展趨勢等)
行業主要上市公司:Pfizer(NYSE: PFE);君實生物(688180);禮來公司(NYSE: LLY);阿斯利康(NYSE:AZN);復星醫藥(600496);先聲藥業(02096.HK)等
本文核心數據:新冠特效藥定義;新冠特效藥產業鏈;新冠特效藥產業圖譜;新冠特效藥發展歷程;新冠特效藥作用機制;新冠特效藥種類;新冠特效藥研發情況;新冠特效藥獲批情況;新冠特效藥臨床試驗情況;新冠特效藥發展展望
全文統計口徑說明:1)篩選邏輯:①以“新型冠狀病毒感染”為適應癥,②以“抑制劑”關鍵詞,③并篩選“申請上市”和“批準上市”,篩選同時符合以上三種條件的相關藥物;2)篩選時間:截至2023年1月13日。3)特殊注解:僅選取“申請上市”和“批準上市”階段的藥物是因本文主要研究的范圍面世/即將面世的藥物,故本文的范圍并不涵蓋最高研發階段仍處于臨床試驗階段及臨床試驗前的藥物。4)如有其他統計口徑會在圖下注釋標注。
行業概況
1、定義:阻斷新冠病毒在人體內復制
近日,“新冠特效藥”這一名詞在中國討論度極高,何為“新冠特效藥”?所謂“新冠特效藥”主要是以阻斷病毒復制的形式在人體內發揮效用的藥物(本文中統計的獲批指“包含正常審批程序和特殊審批”)。根據前瞻的統計,截至2023年1月13日,全球已批準上市和已申請上市的“新冠特效藥”共計21種。
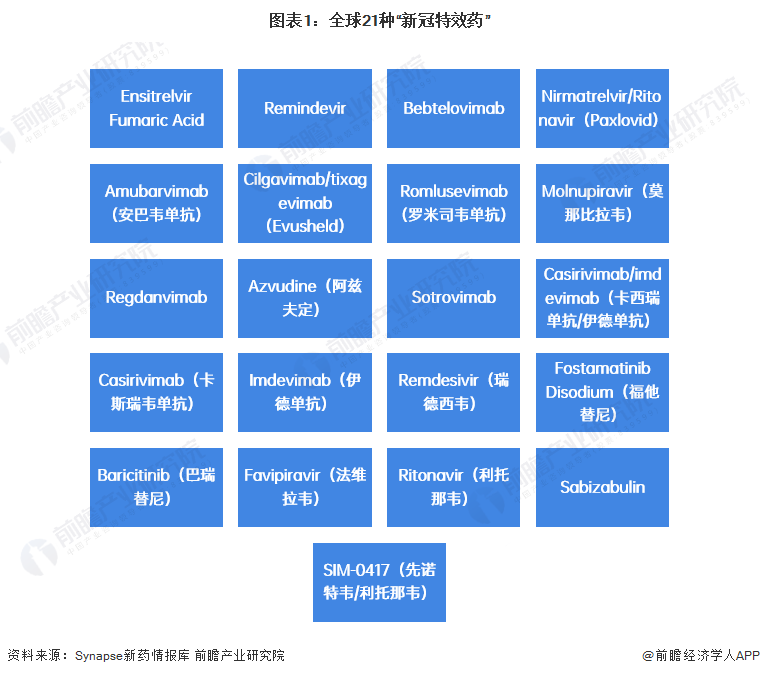
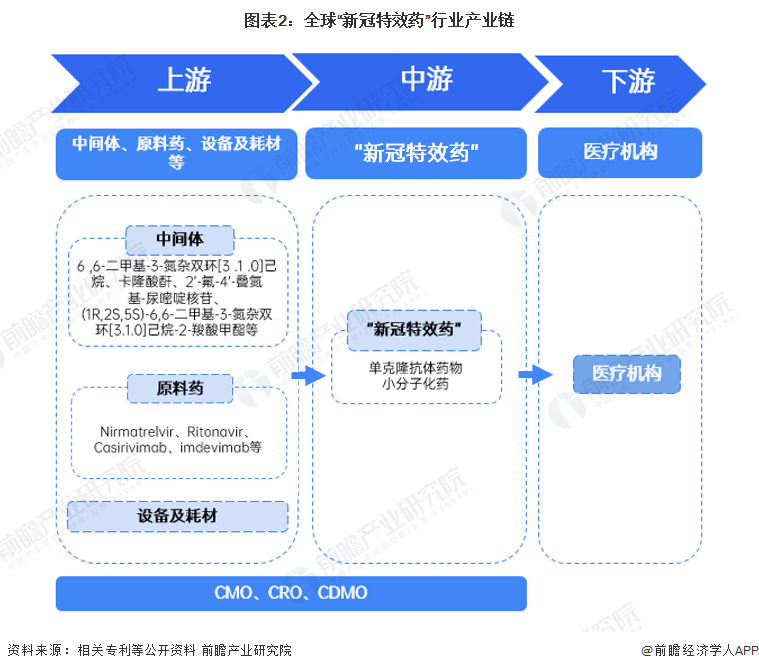
2、產業鏈剖析
“新冠特效藥”行業產業鏈上游主要為醫藥中間體、原料藥,以及設備和耗材等。其中游可根據藥物類型的不同分為單克隆抗體藥物和小分子化藥兩大類。“新冠特效藥”行業的下游不同于傳統醫藥行業,目前,其下游僅限于醫療機構,并未對藥房、藥店等向大眾銷售,即使是歐美等地也需要通過藥劑師的專業評估才能開局處方用于購買“新冠特效藥”。在全球缺乏“新冠特效藥”的情況下,該行業也具有相關的CMO、CRO和CDMO,加速其研發生產。
“新冠特效藥”行業的主要參與者為阿斯利康、輝瑞、禮來公司、開拓藥業、默沙東、真實生物、騰盛博藥、Celltrion、羅氏、吉利德等,值得注意的是,輝瑞、開拓藥業等部分企業本身也具有生產其中間體和原料藥的能力。上游中間體和原料藥的主要參與者包含開拓藥業、君實生物、華騰制藥、艾伯維、CODEXIS、Zenara Pharma和輝瑞等。“新冠特效藥”的CXO領域的參與者包括novasep、華海藥業和Asymchem等,例如輝瑞委托華海藥業負責奈瑪特韋制劑生產,并完成組合包裝。
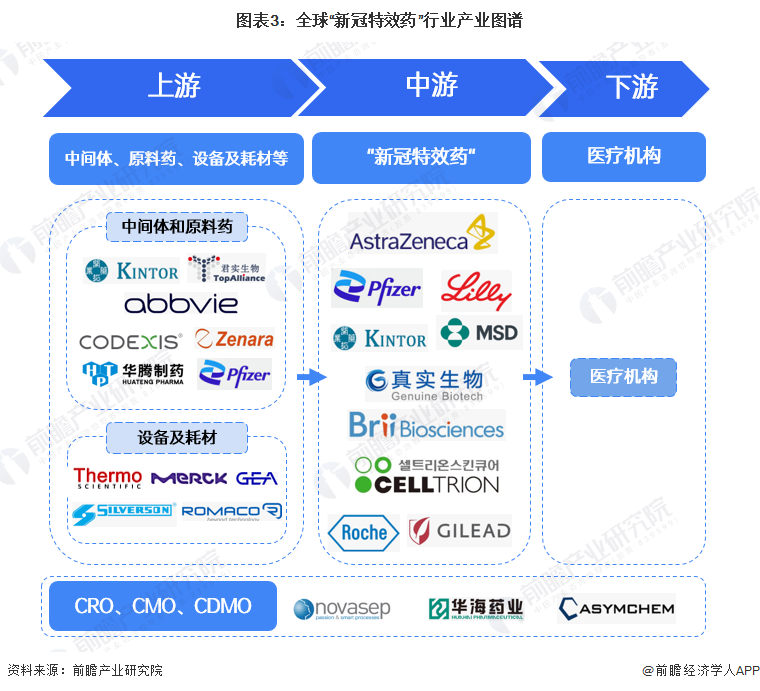
行業發展歷程
自2019年底開始,全球各區域的群眾陸續受新冠病毒感染,對新冠病毒本身的研究和對其相關藥物的研發也加快進程。2020年3月,海正藥業為其片劑Favipiravir法維拉韋在新冠病毒感染適應癥上申請特殊審批進入中國市場,這是目前已獲批和已申請上市的“新冠特效藥”中最早獲批的藥物,此后,2020年陸續又有2個藥物獲批。2021年,藥物研發和審批進度加快,越來越多的藥物通過特殊審批的形式面世,該年共有10個藥物獲批,Paxlovid就是其中一員。2022年,共有4個藥物獲批(包含正常審批程序和特殊審批)。

行業政策背景:藥物在多國獲特殊審批
雖已獲批的藥物已有21個,但其很多都是通過申請各國特殊審批的形式進入市場,例如日本、韓國的緊急使用授權、中國的附條件批準,以及美國的孤兒藥和快速通道等。以Paxlovid為例,截至2022年1月13日,其已獲得美國、印度和韓國針對新冠病毒感染適應癥的緊急使用授權,以及中國針對新冠病毒感染適應癥的附條件批準;此外,Paxlovid在日本、英國、歐盟、冰島、以色列、列支敦士登、挪威和韓國獲批。

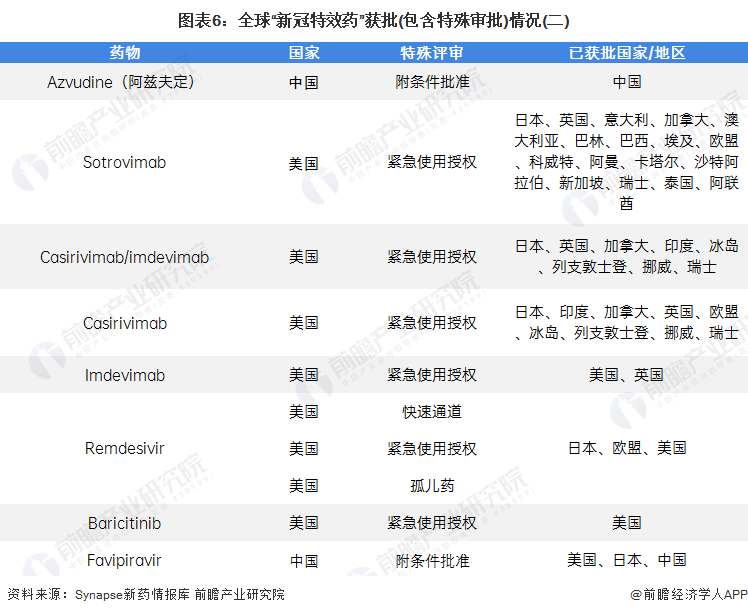
行業發展現狀
1、藥物類型:小分子化藥比例將近6成
截至2023年1月13日,市面上“新冠特效藥”可分為2大類細分藥物類型:小分子化藥和單克隆抗體,兩者的藥物類型數量相差不大,小分子化藥的數量略勝一籌,其占比將近60%。

2、作用機制:RdRp和3CL蛋白酶抑制劑為主流
目前,“新冠特效藥”的作用機制主要為RdRp抑制劑和3CL蛋白酶抑制劑。RdRp抑制劑的作用原理為作用于新型冠狀病毒的RdRp靶點達到精準阻斷新型冠狀病毒RNA復制的作用,這一類藥物目前共計4個,分別為Remindevir、Molnupiravir(莫那比拉韋)、阿茲夫定、Remdesivir(瑞德西韋)。3CL蛋白酶抑制劑的作用原理是通過抑制病毒蛋白剪切,進而阻斷病毒復制,目前這一類藥物共有4個,分別為Ensitrelvir Fumaric Acid(XOCOVA)、Paxlovid、Cilgavimab/tixagevimab(Evusheld)和SIM-0417(先諾特韋/利托那韋)。

3、獲批時間:集中在2021年
2020-2022年,全球共計17個“新冠特效藥”獲批上市(正常獲批程序和特殊審批),獲批的主要時間段均集中在2021年期間,尤其是2021年12月,共計4個藥物通過審批。
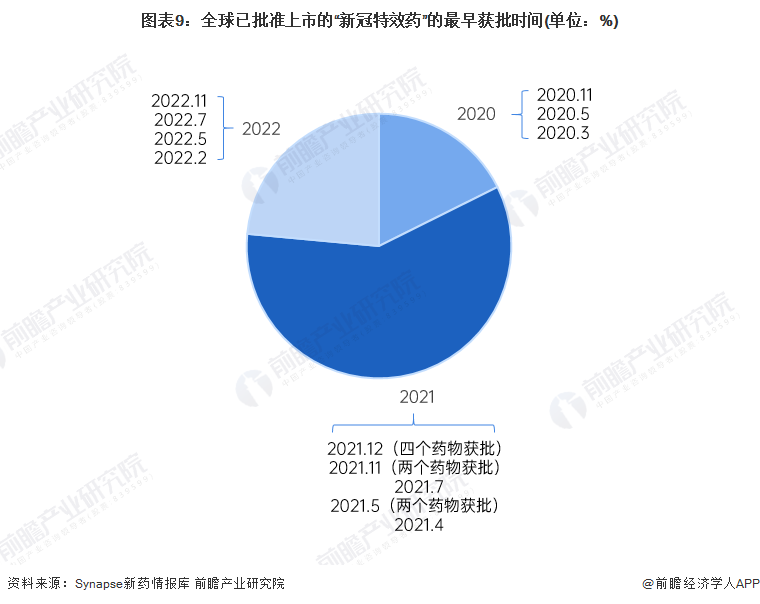
注:上圖中的數據僅指該藥物在新型冠狀病毒感染這類適應癥下的最高藥物獲批情況。
4、研發階段
——仍有4個藥物處于申請上市階段
全球21個已批準上市和已申請上市的“新冠特效藥”中,共計85%的藥物已達到在某個國家/地區批準上市,目前有4個藥物仍處于申請上市的狀態,分別為Fostamatinib Disodium(福他替尼)、Ritonavir(利托那韋)、Sabizabulin和SIM-0417(先諾特韋/利托那韋),四者目前最高進展均到申請上市的階段。

注:上圖中的數據僅指該藥物在新型冠狀病毒感染這類適應癥下的最高藥物研發情況。
——臨床3期的臨床試驗占45%左右
從全球已申請和已獲批的“新冠特效藥”不同階段臨床試驗數量分布情況來看,處于臨床3期的臨床試驗數量較多,其占比約為45%左右。處于臨床2+3期和2期的臨床試驗分別占21%和17%左右。
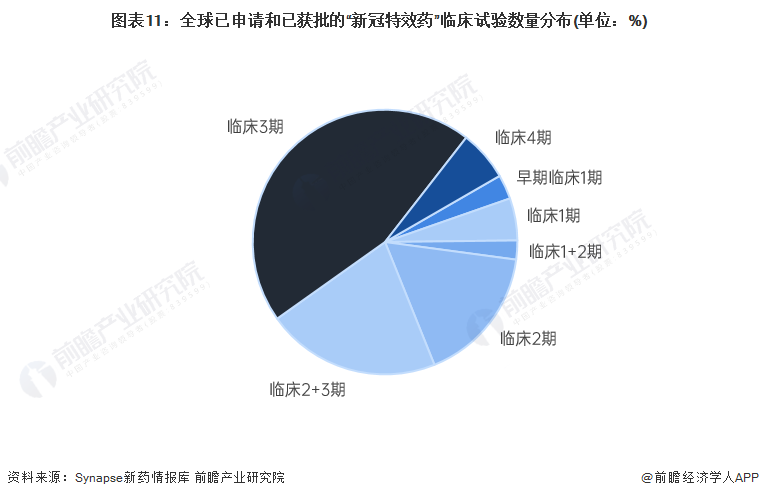
注:上圖中的數據指該藥物在新型冠狀病毒感染這類適應癥下的臨床試驗數量。
行業發展格局
1、企業發展格局:北美、歐洲、亞洲共同推動行業研發
全球“新冠特效藥”主要在研企業分布在北美、歐洲和亞洲地區。北美地區主要是美國和加拿大兩地,例如美國的輝瑞、加拿大的Appili Therapeutics。歐洲地區的主要在研企業分布在英國,例如英國的阿斯利康和葛蘭素史克,以及美國制藥企業在歐洲的分部。亞洲地區的在研企業分散在中國、日本、韓國以及印度,印度部分企業還具有仿制藥生產的“重任”。
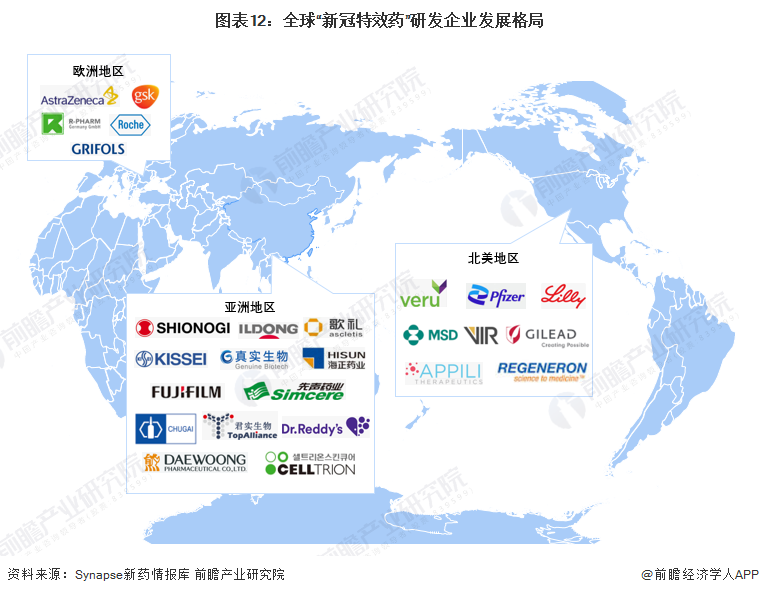
2、區域發展格局
——在美開展的臨床試驗數量遙遙領先
臨床試驗開展區域方面,全球“新冠特效藥”在美國地區開展了最多的臨床試驗,其數量超200多個。其次是西班牙和英國,兩地所開展的“新冠特效藥”臨床試驗分別為167個和139個。

——在英國獲批和申請上市的藥物數量最多
對全球21個已獲批和申請上市的“新冠特效藥”獲批區域進行統計發現,21個藥物中有11個藥物在英國獲批或申請上市。跟在其后的是中國、日本、美國和歐盟,分別有9、8、7、7個藥物在當地獲批或申請上市。

——中國是最受歡迎在研企業注冊地
全球“新冠特效藥”在研企業的注冊地較多地分布在中國,但這些在中國的在研企業并非全是中國本土企業,有幾乎一半的企業是在中國駐扎的外資企業。其次是美國和日本,兩地的在研企業分別為9個和8個。
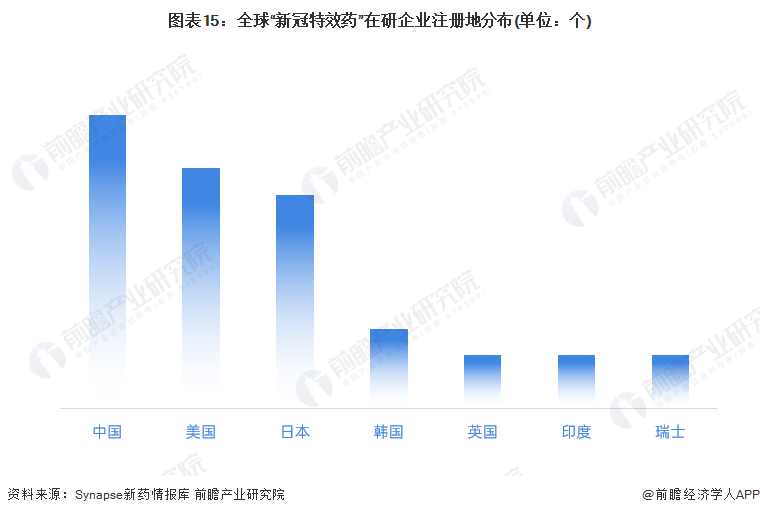
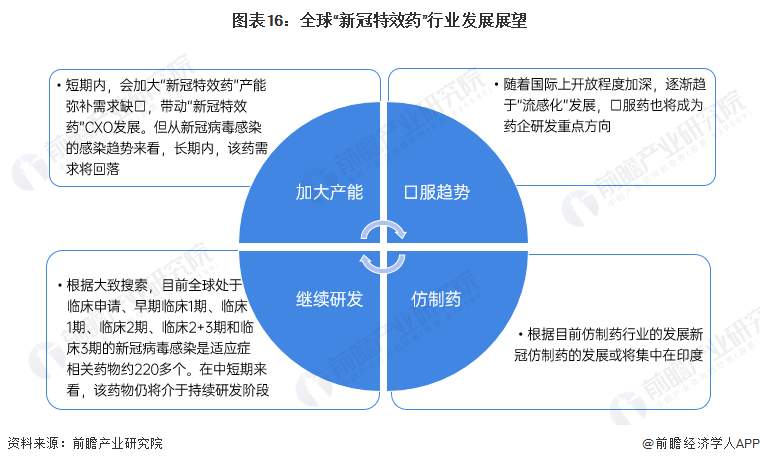
行業發展展望
根據目前全球“新冠特效藥”行業的發展情況和新冠病毒感染發展趨勢,結合全球醫藥行業區域發展情況,前瞻認為:全球“新冠特效藥”行業在短期內或將加大產能且繼續介于持續研發階段,但長期來看藥物需求將回落,藥物劑型也將轉變為口服藥類型。從藥品仿制的角度來看,未來發展格局也將跟隨仿制藥行業的區域布局。
更多本行業研究分析詳見前瞻產業研究院《中國抗病毒藥物行業深度調研與投資戰略規劃分析報告》《全球抗病毒藥物行業市場調研與發展前景預測分析報告》。
同時前瞻產業研究院還提供產業大數據、產業研究報告、產業規劃、園區規劃、產業招商、產業圖譜、智慧招商系統、IPO募投可研、IPO業務與技術撰寫、專精特新小巨人申報、十五五規劃等解決方案。
更多深度行業分析盡在【前瞻經濟學人APP】,還可以與500+經濟學家/資深行業研究員交流互動。
前瞻產業研究院 - 深度報告 REPORTS
本報告前瞻性、適時性地對抗病毒藥物行業的發展背景、供需情況、市場規模、競爭格局等行業現狀進行分析,并結合多年來抗病毒藥物行業發展軌跡及實踐經驗,對抗病毒藥物行...
如在招股說明書、公司年度報告中引用本篇文章數據,請聯系前瞻產業研究院,聯系電話:400-068-7188。

前瞻經濟學人
專注于中國各行業市場分析、未來發展趨勢等。掃一掃立即關注。





























