2018年歐美及中國兒科用藥行業政策匯總 加大兒科藥物研發支持,鼓勵申報兒科用藥
以美國為代表的發達國家通過立法逐步建立了較為完善的兒童用藥管理制度,歐美國家的兒科藥物立法及政策對我國兒科藥物政策的發布有一定的借鑒作用。我國兒科藥物的政策立法起步較晚,2014年《關于保障兒童用藥的若干意見》,是我國幾十年來首部關于兒童用藥的綜合性指導文件,之后為落實《意見》中相關措施,不斷出臺多項有關兒童藥物的政策,推動了我國兒科藥物行業健康快速發展。2016-2019年,三部委發布三批共計108種兒科藥品種,充分彰顯了三部委鼓勵研發申報兒童藥品的決心和力度,也使我國兒科用藥行業發展目標更加具體化。
歐美國家為兒科用藥政策先行者,政策出臺鼓勵兒科用藥研發
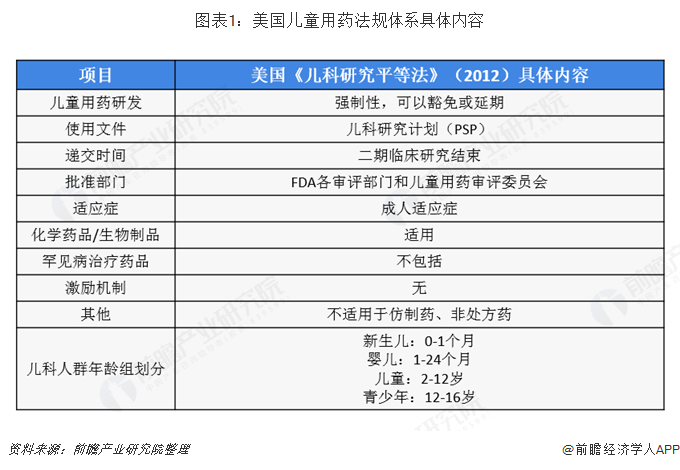
以美國為代表的發達國家通過立法逐步建立了較為完善的兒童用藥管理制度。發達國家對兒童新藥的開發、兒童臨床試驗的管理、兒童藥品的信息提供均從保護兒童權益的角度進行了規定,強制性要求制藥企業對每一種可能發展為兒童用藥的新藥必須提供該藥的兒科研究數據。同時也對制藥企業進行兒童新藥開發提供了包括資金、稅收、快速評審、市場壟斷權和研究資助等諸多方面的優惠措施。美國為了獲取更多的數據支持兒童用藥,促成了兩個互補的法律問世,即《兒科研究平等法》(PREA)和《最佳兒童藥品法》(BPCA)。
目前,美國兒科用藥的兩部法律根據2012年的《FDA安全與創新法》被授權長期有效,根據2012年前的PREA,未要求企業在新藥研制中遞交兒童用藥研究計劃和時間表,2012年7月之后,根據《FDA安全與創新法》的相關條款,研究者應當在新藥研制的早期階段就遞交兒童用藥的初期研究計劃,目的是在研制成人用新藥的同時,盡早考慮未來能否適用于兒童,并根據計劃開展與研制同步的兒童用藥試驗。FDA在2016年3月頒布《兒童用藥研究計劃:兒童用藥初期研究計劃及后續修訂計劃的內容和程序》作為指南草案公開征求意見,并且計劃頒布與《FDA安全與創新法》有關條款相銜接的法規。
歐盟針對兒科用藥的法律為2007年1月27日設立的《兒科藥品管理條例》(ThePediatricRegulation,PR),根據該條例,自2008年7月26日起,所有新藥申請必須提交兒童藥物研發計劃(pediatricinvestigationplan,PIP),自2009年1月26日起,新適應癥、新處方、新劑型的補充申請也必須包括兒童用藥研制計劃。
PIP的基本要求與美國的PSP相一致。歐盟要求申請者在成人的一期臨床試驗結束就遞交PIP,以促使兒童藥物研發計劃從一開始就成為整個藥物研發計劃的一部分。EMA收到PIP申請后,在30天內進行審查,之后兒科委員會(pediatriccommittee,PDCO)在60d內進行審評并給出意見。整個PIP的審評批準時限是140d,如果申請者需要和PDCO進一步討論,則最長不超過290d。PDCO關于PIP的審評意見都在網上公布。

《關于保障兒童用藥的若干意見》為我國首部兒童用藥綜合性指導文件
相對于歐美國家針對兒童用藥立法進程和強制性開發兒童用藥政策而言,我國兒科用藥政策和法規尚處于起步期,長期以來,我國并沒有針對兒童藥物進行專項政策和立法,導致我國兒童藥物法規政策缺乏,企業研發兒童藥物積極性減弱,導致兒童用藥缺失。2014年5月,原衛計委、發改委等六部分聯合印發了《關于保障兒童用藥的若干意見》,是我國幾十年來首部關于兒童用藥的綜合性指導文件,涉及兒童藥研發、使用、報銷的六大相關部委共同參與,不僅有宏觀規劃,更有具體落實措施,更加貼合兒童就醫用藥實際情況,利于兒童藥企業對接,從而促進兒童藥市場擴容。
通過加快申報審評,促進研發創制的舉措鼓勵制藥企業加大對兒童用藥的研發投入和研發熱情;對兒童用藥價格給予專項支持,擴大兒童制藥企業的利潤空間,建立保障預警機制和指導體系,對兒童用藥生產供應進行保障;完善體系建設,提高臨床使用綜合評價能力,完善用藥指南、加強藥品說明書管理、開展臨床使用綜合評價、完善兒科藥物人才體系建設等。

注重兒童藥物的用藥安全,規范處方行為,發揮藥師作用;大力推進兒科用藥中成藥發展,發揮傳統中醫藥優勢;加強合理用藥宣傳,有關部門和地方積極配合,結合各地特點,細化工作措施。

兒童用藥政策頻發,兒科用藥市場前景廣闊
自2014年六部委《關于保障兒童用藥的若干意見》印發后,為我國兒科藥物發展指明了方向,后續幾年中,國家頻頻出臺政策支持兒科用藥行業發展,并不斷修正使得我國兒科藥物行業快速健康發展。未落實《關于保障兒童用藥的若干意見》中的相關要求,2016年1月,《關于臨床急需兒童用藥申請優先審評審批品種評定基本原則及首批優先審評品種的公告》中確定了兒童用藥優先審評審批的品種;2016年3月,《兒科人群藥物臨床試驗技術指導原則》為兒科用藥臨床試驗實施提供指南;2016-2019年,期間衛計委、工信部和食藥監局推出3批鼓勵研發申報兒童藥品清單共計108種,極大的豐富了兒科用藥品類。


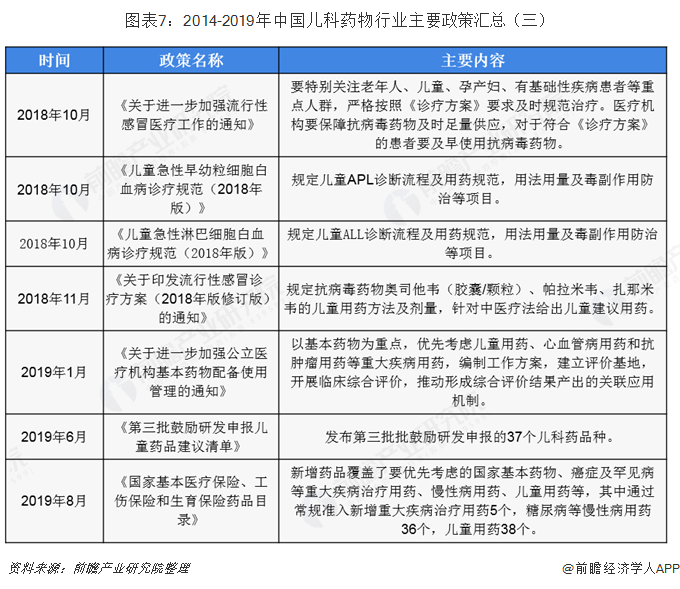
三批清單涵蓋108種類,三部委鼓勵研發申報兒童藥品
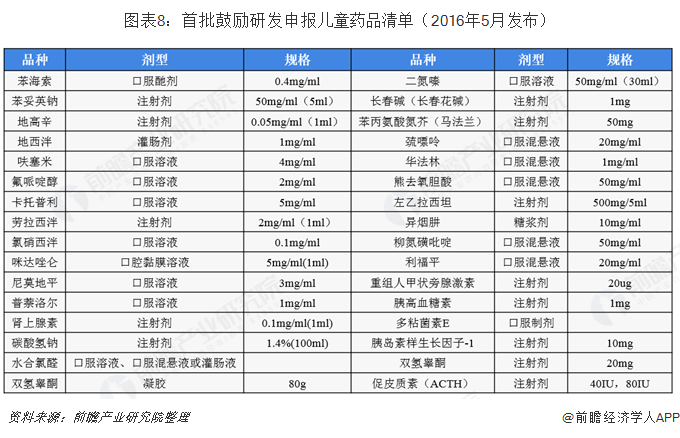
我國兒科藥物行業近來來最大的政策激勵就是2016-2019年由衛計委、工信部和食藥監局三部委發布的,連續三批鼓勵研發申報兒童藥品清單。根據中央全面深化改革領導小組辦公室2016年重點改革任務分工安排,為深化醫改,進一步做好保障兒童用藥工作,促進兒童適宜品種、劑型、規格的研發創制和申報審評,滿足兒科臨床用藥需求,國家衛生計生委、工業和信息化部、食品藥品監管總局組織專家制定了《首批鼓勵研發申報兒童藥品清單》,涵蓋了32個兒科用藥品種;2017年5月,三部委印發了《第二批鼓勵研發申報兒童藥品清單》,涵蓋了39個兒科藥品種;2019年6月,《第三批鼓勵研發申報兒童藥品清單》出爐,涵蓋了37個兒科藥品種。三批清單共涵蓋了108個種類的兒科藥品種,充分彰顯了三部委鼓勵研發申報兒童藥品的決心和力度,也使我國兒科用藥行業發展目標更加具體化。


以上數據及分析均來自于前瞻產業研究院《中國兒科用藥行業市場前瞻與投資戰略規劃分析報告》
更多深度行業分析盡在【前瞻經濟學人APP】,還可以與500+經濟學家/資深行業研究員交流互動。
前瞻產業研究院 - 深度報告 REPORTS
本報告主要從兒科用藥各細分市場的角度來對進行闡述與分析,詳盡地分析了兒科用藥細分市場的發展概況、藥品競爭格局、企業地位競爭等;并深入的介紹了各類藥物中主要產品...
如在招股說明書、公司年度報告中引用本篇文章數據,請聯系前瞻產業研究院,聯系電話:400-068-7188。

前瞻經濟學人
專注于中國各行業市場分析、未來發展趨勢等。掃一掃立即關注。





























